En la mayoría de los casos, se realiza una meniscectomía parcial tras una lesión de menisco. En los años siguientes, se desarrolla un síndrome postmeniscectomía con artrosis secundaria. Esta situación conduce entonces a un tratamiento protésico correspondiente. En la literatura se describen diversas técnicas para la regeneración del cartílago. Entre ellas se encuentran el trasplante de cartílago autólogo...
Autor:
Dr. Olaf Thorsten Beck
Especialista en ortopedia, traumatología, cirugía y medicina deportiva
Weisser Str. 22, D-50996 Köln/Colonia/Cologne
info@arthro-prax.de
Introducción:
En la mayoría de los casos, se realiza una meniscectomía parcial tras una lesión de menisco. En los años siguientes, se desarrolla un síndrome postmeniscectomía con artrosis secundaria. Esta situación conduce entonces a un tratamiento protésico correspondiente.
En la literatura se describen diversas técnicas para la regeneración del cartílago. Entre ellas se encuentran el trasplante de cartílago autólogo y la inducción de cartílago con una matriz libre de células, el colágeno tipo 1, así como diversas técnicas de sustitución del menisco. En el pasado, el implante CMI fabricado a partir de tendones de Aquiles bovinos era el líder del mercado. Sin embargo, su producción se interrumpió en 2021. A partir de ese momento, solo se disponía del implante Actifit como sustitución parcial. Sin embargo, a diferencia del CMI, no se trataba de un implante biológico, sino de poliuretano. Diversos estudios han demostrado que el resultado era inferior al de la CMI. Un nuevo implante biológico está disponible en Alemania desde noviembre de 2022 y actualmente puede ser utilizado por 4 médicos en Alemania. Se trata de un bloque de hueso esponjoso cadavérico desmineralizado y libre de ADN. El implante se suministra estéril y seco. Actualmente, no se dispone de estudios sobre una combinación de regeneración de cartílago en relación con la implantación de menisco.
Descripción de la técnica:
El paciente debe tener una desalineación máxima de varo y valgo de 5°. Otras contraindicaciones son la rigidez articular, la inflamación crónica de las articulaciones como el reumatismo, la artritis psoriásica y la artritis úrica. Las alergias a las proteínas bovinas también son una contraindicación.
También es importante que el paciente cumpla las normas, ya que el éxito de la operación depende en gran medida del cumplimiento del régimen postoperatorio.
Hasta ahora, he tratado a pacientes de hasta 65 años con esta intervención. Sin embargo, aquí hay que tener en cuenta sobre todo las enfermedades concomitantes. Los pacientes que tienen que tomar cortisona o medicamentos antirreumáticos con regularidad han sido rechazados por mí.
También es importante hacer el diagnóstico correcto mediante imágenes, lo que sólo es posible con la ayuda de una resonancia magnética. Si hay alteraciones óseas en el sentido de edema óseo, debe proporcionarse el alivio adecuado mediante una órtesis y terapia focalizada con ondas de choque. La frecuencia de aplicación depende del tamaño de la zona. Por término medio, realizo 4 aplicaciones a intervalos de 1 semana. 6 semanas después del último tratamiento con ondas de choque se realiza una resonancia magnética de control.
También debe determinarse el tamaño del defecto cartilaginoso y el borde del menisco. La geometría del defecto cartilaginoso es importante. La inducción de cartílago es posible si el defecto tiene una anchura de hasta 1,5 cm. En ese caso, la longitud ya no desempeña ningún papel. Basándonos en nuestro esquema postoperatorio, también es posible el tratamiento de las lesiones en beso.
El menisco residual debe tener un borde de 3 mm y una fijación intacta del cuerno anterior y posterior.
Si esta información no puede determinarse mediante resonancia magnética, realizo una nanoscopia bajo anestesia local con fines de planificación.
Durante la artroscopia, el primer paso es preparar el cartílago utilizando una cureta anular. El aberat se retira con una rasuradora. El implante de menisco (Spongioflex) se coloca en solución salina durante unos 15 minutos hasta que esté blando. El implante se introduce en la articulación a través de una incisión miniabierta con unas pinzas de agarre para meniscos y se fija con suturas internas. A continuación, el procedimiento pasa de la artroscopia con agua a la artroscopia con gas. En este caso se utiliza CO2. El supresor se conecta a través de un tubo de gas que puede conectarse al trocar de artroscopia.
Una vez secas las zonas del defecto cartilaginoso, se cubren con un gel de colágeno.
Resultados propios:
Hasta la fecha no se han publicado resultados de seguimiento de esta técnica combinada. Sin embargo, dado que el implante Spongioflex es también un implante biológico, cabe suponer que los resultados serán similares a los del implante CMI. Así lo confirman también las breves entrevistas que he realizado y un examen histológico. He utilizado un total de 21 implantes Spongioflex desde noviembre de 2022. Ha habido 2 complicaciones causadas por los propios pacientes (arrancamiento debido a una caída o a una carga incorrecta). Un implante pudo implantarse de nuevo. El segundo implante se retiró y se examinó histológicamente. En él se observó migración celular de células cartilaginosas después de sólo 4 semanas, lo que corrobora la suposición que hice anteriormente.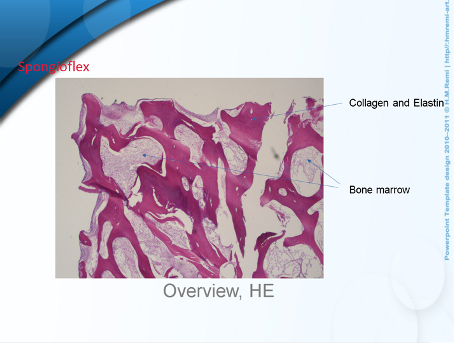
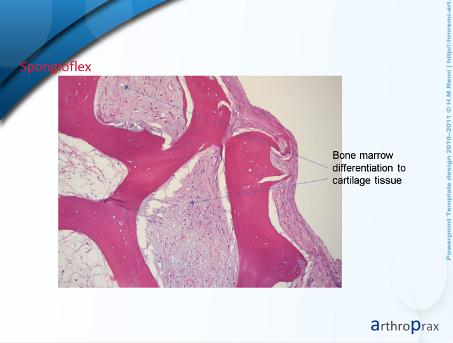
La sección histológica muestra la integración de células cartilaginosas en el tejido de soporte óseo. Está pendiente un examen inmunohistológico.
No se han producido más complicaciones.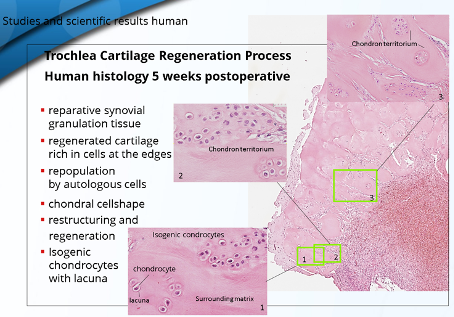
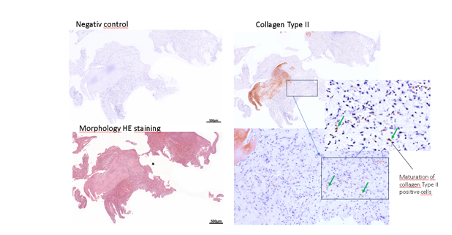
El examen histológico de una muestra de defecto del líquido Chondrofiller, también después de 4 semanas, mostró la migración de condrocitos y la presencia de colágeno en el examen inmunohistológico.
Del 12.2018 al 05.2023, un total de 23 hombres y 8 mujeres fueron tratados con esta técnica combinada de inducción de cartílago e implantación parcial de mensicus. Estos 31 pacientes fueron tratados con CMI en 17 casos y con Actifit en 15 casos. Un paciente fue tratado bilateralmente con CMI a intervalos de 7 meses.
Todos los pacientes presentaban daños en el menisco medial o lateral. No se realizó el tratamiento simultáneo de las lesiones de menisco medial y lateral.
El examen de seguimiento se realizó en 11 hombres y 5 mujeres con una edad media de 58 años (42-69 años) utilizando el cuestionario IKDC después de una media de 24 meses (3-39,5 meses).
Se observó que a un paciente tratado con CMI se le colocó una prótesis completa o de trineo al cabo de 8 meses y a dos pacientes tratados con Actifit al cabo de 8 y 10 meses respectivamente.
En el grupo CMI, se produjo una mejoría media de 35,1 (25,3-37,9) a 82,3 (55,8-93,1) tras el IKDC y con Actifit de30,4 (21,8-54) a 73,4 (56,3-83,5).
No se produjeron complicaciones (dislocación meniscal, reacciones alérgicas, dislocaciones del anclaje meniscal) durante los procedimientos. Todos los pacientes se sometieron a un régimen de tratamiento postoperatorio estandarizado.
Estos resultados demuestran que una combinación de ambos procedimientos biológicos, con la indicación correcta, puede evitar la implantación de prótesis o, debido a la falta de estudios a largo plazo, al menos retrasarla.
Bibliografía
Literatura Regeneración del cartílago
1. Beck OT: Cartilage repair with cell-free collagen (Chondrofiller liquid).
Clinical and MRI study.
OUP 2018; 7: 620–625 DOI 10.3238/oup.2018.0620–0625
2. Bentley, G, Biant, LC, Carrington, RWet al: A prospective, randomised comparison of autologous chondrocyte implantation versus mosaicplasty for osteochondral defects in the knee.
J Bone Joint Surg Br. 2003; 85: 223–30
3. Breil-Wirth A, von Engelhardt LV, Lobner, S, Jerosch J: Retrospective study of cell-free collagen matrix for cartilage repair
OUP 2016; 9: 515–20
4. Dozin B, Malpeli M, Cancedda R et al:
Comparative evaluation of autologous chondrocyte implantation and mosaicplasty: a multicentered randomized clinical trial. Clin J Sport Med. 2005; 15: 220–26
5. Filova E, Ramoichová M, Handl M et al.: Composite hyaluronate-type I collage-fibrin scaffold therapy of osteochondral defects in miniature pigs;
Physiol Res 2007; 56 (Suppl.1): 5–16
6. Gavenis K, Schmidt-Rohlfing B, Andereya S et al: A cellfree collagen type I device for the treatment of focalcartilage defects. Artif Organs 2010;
34: 79–83
7. Gobbi A, Karnatzikos G, Kumar A: Long-term results after microfracture treatment for full thickness knee chondral lesions in athletes;
Knee Surg Sports Traumatol Arthrosc. 2014; 22: 1986–96
8. Gotterbarm T, Breusch SJ, Schneider U, Jung M: The minipig model for experimental chondral and osteochondral defect repair in tissue engeneering: retrospectiveanalysis of 180 defects.
Lab Anim. 2008; 42: 71–82
9. Gudas R, Simonaityte R, Cekanauskas E et al.: A prospective, randomized clinical study of osteochondral autologous transplantation versus microfracture for the treatment of osteochondritis dissecans in the knee joint in children.
J Pediatr Orthop. 2009; 29: 741–8
10. Gudas R, Stankevicius E, Monastyreckiene E et al.: Osteochondral autologous transplantation versus microfracture for the treatment of articular cartilage defects in the knee joint in athletes.
Knee Surg Sports Traumatol Arthrosc. 2006; 14: 834–42
11. Hangody L, Dobos J, Baló E et al.: Clinical experiences with autologous osteochondral mosaicplasty in an athletic population: a 17-year prospective multicenter study. Am J Sports Med. 2010;
38: 1125–33
12. Hangody L, Füles P: Autologous osteochondral mosaicplasty for the treatment of full-thickness defects of weightbearing joints: ten years of experimental and clinical experience.
J Bone Joint Surg Am. 2003; 85-A Suppl 2: 25–32
13. Horas U, Pelinkovic D, Herr G et al: Autologous chondrocyte implantation and osteochondral cylinder transplantation in cartilage repair of the knee joint. A prospective, comparative trial.
J Bone Joint Surg Am. 2003; 85A: 185–92
14. Jung M, Tuischer JS, Sergei C et al.: Local applicationof a collagen type I/hyaluronate matrix growth and differentiation factor 5 influences the closure of osteochondral defects in a minipig model by enchondral ossification.
Growth Factors 2006; 24: 225–32
15. Schüttler KF, Schenker H, Theisen C et al.: Use of cell-free collagen type I matrix implants for the treatment of small cartilage defects in the knee: clinical and magnetic resonance imaging evaluation.
Knee Surg Sports Traumatol Arthrosc. 2014; 22: 1270–6
16. Knutsen G, Engebretsen L, Ludvigsen TC et al.: Autologous chondrocyte implantation compared with microfracture in the knee. A randomized trial.
J Bone Joint Surg Am 2004; 86-A: 455–64
17. Matzek j, Gnatowski M, Porthos Salas A, O´Donnell JM, Domzalski M, Radzimowski J: Arthroscopic utilization of Chondrodiller Liquid gel for the treatment of hip articular cartilage defects: a cohort study with 12- to 60- month follow up.
J Hip Preserv Surg 2021; 8(1):22-27
18. National Institute for Health and Care Excellence (NICE): Mosaicplasty for knee cartilage defects.
Published March 2018; (https://www.nice.org.uk/guidance/ipg607)
19. Niemeyer P, Pestka JM, Kreuz PC et al.: Characteristic Complications After Autologous Chondrocyte Implantation for Cartilage Defects of the Knee Joint.
Am J Sports Med. 2008; 36: 2091–9
20. Schneider U: Controlled, randomized multicenter study to compare compatibility and safety of ChondroFiller Liquid (cell-free 2-component collagengel) with microfracturing of patients with focal cartilage defects of the knee joint;
Video J Orthop Surg 2016; 1: 1–8
21. Schneider U, Rackwitz L, Andereya S et al.: A prospective multicenter study on the outcome of type I collagen hydrogel-based autologous chondrocyte implantation (CaReS) for the repair of articular cartilage defects in the knee.
Am J Sports Med. 2011; 39: 2558–65
22. Steadman JR, Briggs KK, Rodrigo JJ et al.: Outcomes of microfracture for traumatic chondral defects of the knee: Average 11-year follow-up.
Arthroscopy 2003; 19: 477–484
Literatura Implantes de menisco
1. Bulgheroni E., Grassi A., Campagnolo M., et al. Comparative study of collagen versus Synthetic-Based meniscal scaffolds in treating meniscal deficiency in young active population.
Cartilage. 2016; 7: 29-38 (https://doi.org/10.1177/1947603515600219)
2. de Caro F., Perdisa F., Dhollander A., et al. Meniscus scaffolds for partial meniscus defects.
Clin Sports Med. 2020; 39: 83-92 (https://doi.org/10.1016/j.csm.2019.08.011)
3. Dhollander A., Condello V., Madonna V. Meniscal Augmentation and Replacement (Menaflex, Actifit, and NUsurface).
in: Farr J. Gomoll A. Cartilage Restoration. Springer, Cham2018 (ISBN: 978-3-319-77152-6)
4. Faivre B., Bouyarmane H., Lonjon G., et al. Actifit® scaffold implantation: influence of preoperative meniscal extrusion on morphological and clinical outcomes.
Orthop Traumatol Surg Res. 2015; 101: 703-708 (https://doi.org/10.1016/j.otsr.2015.06.016)
5. Filardo G., Andriolo L., Kon E., et al. Meniscal scaffolds: results and indications. A systematic literature review.
Int Orthop. 2015; 39: 35-46 (https://doi.org/10.1007/s00264-014-2415-x)
6. Grassi Alberto et al. Minimum 10-Year Clinical Outcome of Lateral Collagen Meniscal Implants for the Replacement of Partial Lateral Meniscal Defects: Further Results from a Prospective Multicenter Study.
Orthop J Sports Med 2021 May 25; 9(5):2325967121994919. doi: 10.1177/2325967121994919. eCollection 2021 May.
7. Holsten D, Andreß B: Meniscal replacement in athletes.
OUP 2014; 6: 286–291 DOI 10.3238/oup.2014.0286–0291
8. Kohli, S., Schwenck, J. & Barlow, I. Failure rates and clinical outcomes of synthetic meniscal implants following partial meniscectomy: a systematic review.
Knee Surg & Relat Res 34, 27 (2022). (https://doi.org/10.1186/s43019-022-00155-1)
9. Kovacs B.K., Huegli R., Harder D.,et al. MR variability of collagen meniscal implant remodelling in patients with good clinical outcome.
Knee Surg Sports Traumatol Arthrosc. 2021; 29: 90-99 (https://doi.org/10.1007/s00167-019-05715-9)
10. Kwon H., Brown W.E., Lee C.A., et al. Surgical and tissue engineering strategies for articular cartilage and meniscus repair.
Nat Rev Rheumatol. 2019; 15: 550-570 (https://doi.org/10.1038/s41584-019-0255-1)
11. Linke, R.D., Ulmer, M. & Imhoff, A.B. Replacement of the Meniscus with a Collagen Implant (CMI).
Orthop Traumatol 18, 453–462 (2006). (https://doi.org/10.1007/s00064-006-1188-9)
12. Leroy A, Beaufils P, Faivre B , Steltzlen C, Boisrenoult P, Pujol N
Actifit® polyurethane meniscal scaffold: MRI and functional outcomes after a minimum follow-up of 5 years Orthopaedics & Traumatology: Surgery & Research 103 (2017) 609–614.
14. Pereira H., Cengiz I.F., Vilela C., da Silva Morais A., Oliveira J.M. ,Reis R.L. et al. Emerging Concepts in Treating Cartilage, Osteochondral Defects, and Osteoarthritis of the Knee and Ankle.
Adv Exp Med Biol. 2018; 1059: 25-62 (https://doi.org/10.1007/978-3-319-76735-2_2)
15. Rodkey William G, Steadman J.Richard
Paper #30 Collagen Meniscus Implants (CMI): multicenter clinical trial results and long term follow-up
Abstract| Volume 19, ISSUE 6, SUPPLEMENT , 16-17, July 2003; (https://doi.org/10.1016/S0749-8063(03)00434-1)
16. Schenk L., Bethge L., Hirschmann A., et al. Ongoing MRI remodeling 3–7 years after collagen meniscus implantation in stable knees.
Knee Surg Sports Traumatol Arthrosc. 2020; 28: 1099-1104 (https://doi.org/10.1007/s00167-019-05714-w)
17. Schüttler K.F., Pöttgen S., Getgood A., et al. Improvement in outcomes after implantation of a novel polyurethane meniscal scaffold for the treatment of medial meniscus deficiency.
Knee Surg Sports Traumatol Arthrosc. 2015; 23: 1929-1935 (https://doi.org/10.1007/s00167-014-2977-6)
18. Shin Y.-S., Lee H.-N., Sim H.-B., et al. Polyurethane meniscal scaffolds lead to better clinical outcomes but worse articular cartilage status and greater absolute meniscal extrusion.
Knee Surg Sports Traumatol Arthrosc. 2018; 26: 2227-2238 (https://doi.org/10.1007/s00167-017-4650-3)
19. Toanen C., Dhollander A., Bulgheroni P.,et al. Polyurethane meniscal scaffold for the treatment of partial meniscal deficiency: 5-year follow-up outcomes: a European multicentric study.
Am J Sports Med. 2020; 48: 1347-1355 (https://doi.org/10.1177/0363546520913528)
20. Zaffagnini S., Grassi A., Marcheggiani Muccioli G.M., et al. MRI evaluation of a collagen meniscus implant: a systematic review.
Knee Surg Sports Traumatol Arthrosc. 2015; 23: 3228-3237m (https://doi.org/10.1007/s00167-014-3155-6)
Descargar versión en PDF
Implantación de menisco y inducción de cartílago


